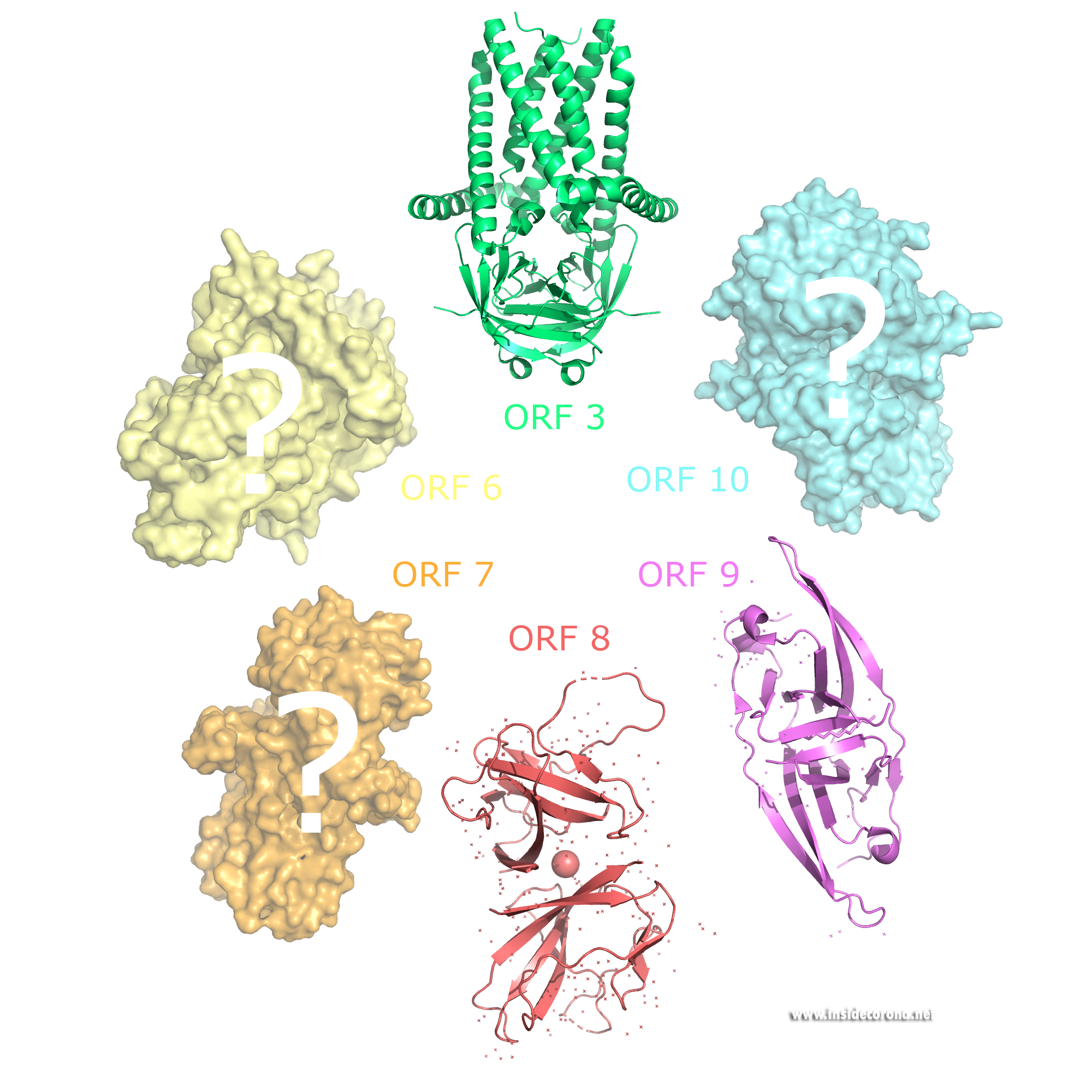
Accessory Proteine sind nicht essentiell für die Replikation in vitro und weniger gut erforscht als die anderen Proteine im Coronavirus. Sie werden entsprechend ihrer Lokalisierung im Genom des Virus benannt, und entsprechend des Leserasters (Open Reading Frame = ORF).
In SARS-CoV-2 ist das Protein ORF3 nur 22 Aminosäurereste lang, während es in SARS-CoV 154 Aminosäurereste hat.
ORF3 unterdrückt die sogenannte Interferon-Antwort, die Teil der Immunreaktion in befallenen Zellen ist.
In Peru gab es COVID-19 Patienten mit einem längeren ORF-3 Protein und es konnte gezeigt werden, dass, je länger ORF3 ist, desto besser kann das Virus das Immunsystem unterdrücken, was den neuen Subtyp aus Peru zu einer ernsten Sache macht.
ORF3 scheint auch eine wichtige Rolle bei der Exkretion neuer Viren zu spielen.
Die Struktur von ORF3a sieht aus wie ein Schwein mit einem Hut. (Siehe: https://www.rcsb.org/structure/6XDC)
ORF6 hemmt ebenfalls Interferon-Signale, was dem Virus hilft, gesunde Zellen zu befallen, aber es scheint nicht essentiell für die virale Replikation zu sein. ORF6 könnte außerdem verhindern, dass Zellen resistent gegen das Virus werden. Bisher ist für ORF6 keine atomare Struktur verfügbar.
ORF7 kann wahrscheinlich das Absterben von befallenen Zellen verursachen, was zur Schwere von COVID-19 Erkrankungen beiträgt. Außerdem gibt es Forschungsergebnisse, die zeigen, dass ORF7 die Tetherin-Menge in der Zelle erniedrigt. Tetherin wird von Zellen verwendet, um Viren, die die Wirtszelle gerade Frisch verlassen haben, an die Zelloberfläche zu binden. So werden diese Virionen festgehalten und können keine weiteren Zellen befallen.
ORF8 hat Zucker gebunden (Glykosilierung), welche das Protein vor Abbau in der Zelle schützen. Es kommt im endoplasmatischen Retikulum und im Cytoplasma vor und hat zwischen SARS-CoV und SARS-CoV-2 die niedrigste Homologie von allen viralen Proteinen. Es gibt Hinweise darauf, dass ORF8 direkt mit MHC-Molekülen interagiert (Hauptgewebeverträglichkeitskomplex) und dafür sorgt, dass diese abgebaut werden. Diese sind ein wichtiger Teil des Immunsystems und ihr Abbau führt dazu, dass T-Zellen daran gehindert werden, befallene Wirtszellen zu zerstören. Die atomare Struktur von ORF8 wurde kürzlich gelöst.
ORF9b-Strukturen sind für SARS-CoV und SARS-CoV2 verfügbar. Die bisher unbekannte Faltung dieses Proteins ist ein beta-Faltblattdimer mit einer wasserabweisenden (hydrophoben) Kontaktfläche mit einer Aushölung, in die Lipide binden könnten. Es könnte ein membranständiges Protein sein und eine untergeordnete Rolle im Bau von Virionen spielen.