Alexander Matthew Payne und Binisha Karki
Einleitung
Haben Sie schon gehört, dass das Corona-Virus „mutiert“? Oder dass weltweit „mehr als ein Stamm“ dieses Virus existiert? Das klingt ziemlich erschreckend, nicht wahr? In Wirklichkeit mutiert aber wirklich alles - alle Organismen, angefangen bei Bakterien bis hin zum Menschen, verändern im Laufe der Zeit ihr Erbgut. Dies kann auch passieren, wenn die DNA (Deoxyribonucleic Acid, zu Deutsch: Desoxyribonukleinsäure) UV-Licht (wie dem der Sonne!) ausgesetzt wird oder während der Replikation der DNA. Bei diesem Vorgang verwendet eine Zelle einen der beiden DNA-Stränge als Vorlage für eine neue, komplementäre Kopie des anderen Strangs. Mutationen treten bei allen Lebewesen (und Viren) auf und sind die Triebkraft der Evolution. In diesem Beitrag befassen wir uns mit der Replikation von Coronaviren unter besonderer Berücksichtigung der beteiligten Proteine.
Wie vermehrt sich das Coronavirus?
SARS-CoV-2 verwendet zur Kodierung seines Genoms nicht DNA, sondern einsträngige Ribonukleinsäure (Ribonucleic Acid, RNA) und wird deshalb der Klasse der „einsträngigen RNA-Viren“ zugeordnet. Aus diesem Grund muss das Virus zur Vervielfältigung seines Genoms einen anderen Weg beschreiten als „normale“ Zellen: Das für die Replikation der RNA zuständige Virusprotein wird als „RNA-abhängige RNA-Polymerase“ (RdRp) bezeichnet. Dieses Protein verwendet die virale RNA als Vorlage für neue Virus-RNA-Kopien; dabei reiht es einzelne Ribonukleotide wie Perlen auf einer Schnur aneinander. Dieser Vorgang wird als Polymerisation bezeichnet.
Eine Studie des AG Mors an der Texas A&M University hat gezeigt, dass die SARS-CoV-2 RNA-Polymerase eine bemerkenswerte Ähnlichkeit mit der RNA-Polymerase von SARS-CoV (> 95 %) und MERS-CoV [1] hat, dem Virus, das das Middle East Respiratory Syndrome verursacht. Wir könnten also vielleicht von den Erkenntnissen aus der SARS- und MERS-Epidemien bei der Bekämpfung von SARS-CoV-2 profitieren. Mit kontinuierlichen Mitteln für die Coronavirus-Forschung in den letzten Jahren hätten wir vielleicht noch mehr über RdRp lernen können. In jedem Fall könnte RNA-Polymerase ein interessanter Ansatzpunkt für Medikamente zur Eindämmung von COVID-19 und zur Senkung der Sterblichkeitsrate sein…
Struktur der RNA-abhängigen RNA-Polymerase
Um ein Medikament so zu optimieren, dass es an dieses Protein bindet und es blockiert, muss man zunächst die Struktur von RdRp bestimmen und seine Funktionsweise umfassend verstehen – und in den vergangenen Monaten wurden hierzu verschiedene Strukturen der SARS-CoV-2 RNA-Polymerase aufgeklärt.
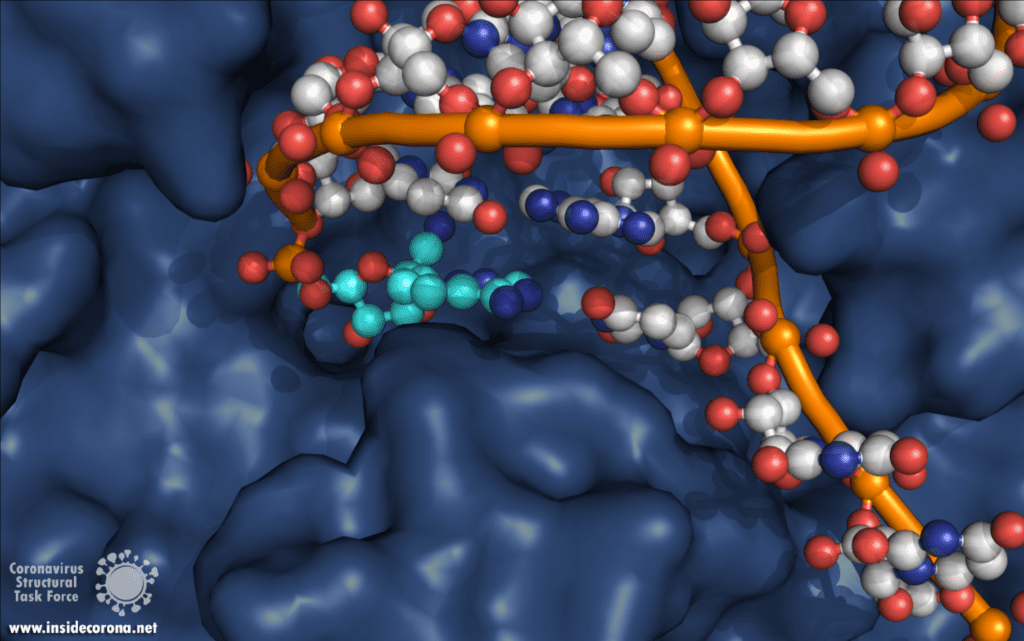
Eine interessante Struktur zeigt die RNA-Polymerase in Aktion: dabei ist zu erkennen, wie ein RNA-Strang verlängert wird (siehe Abbildung 1). Es ist deutlich zu sehen, dass die Polymerase einen Komplex mit kleineren Proteinen, den so genannten Nichtstrukturproteinen 7 und 8 (nsp7 und nsp8), bildet. Diese Proteine stabilisieren die Bindung der RNA-Polymerase an die RNA-Vorlage und erhöhen die „Prozessivität“, also die Zeit, die das Enzym an der Vorlage kleben bleibt, bis es sich wieder ablöst. [3]
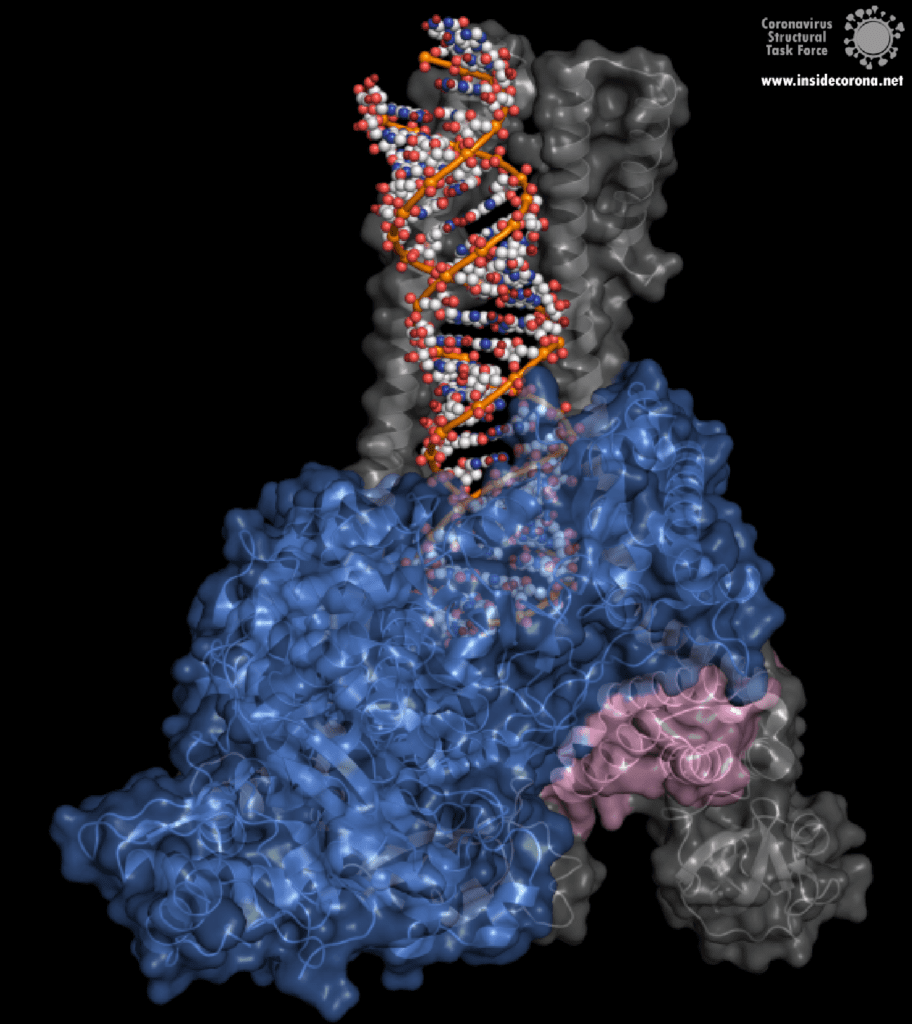
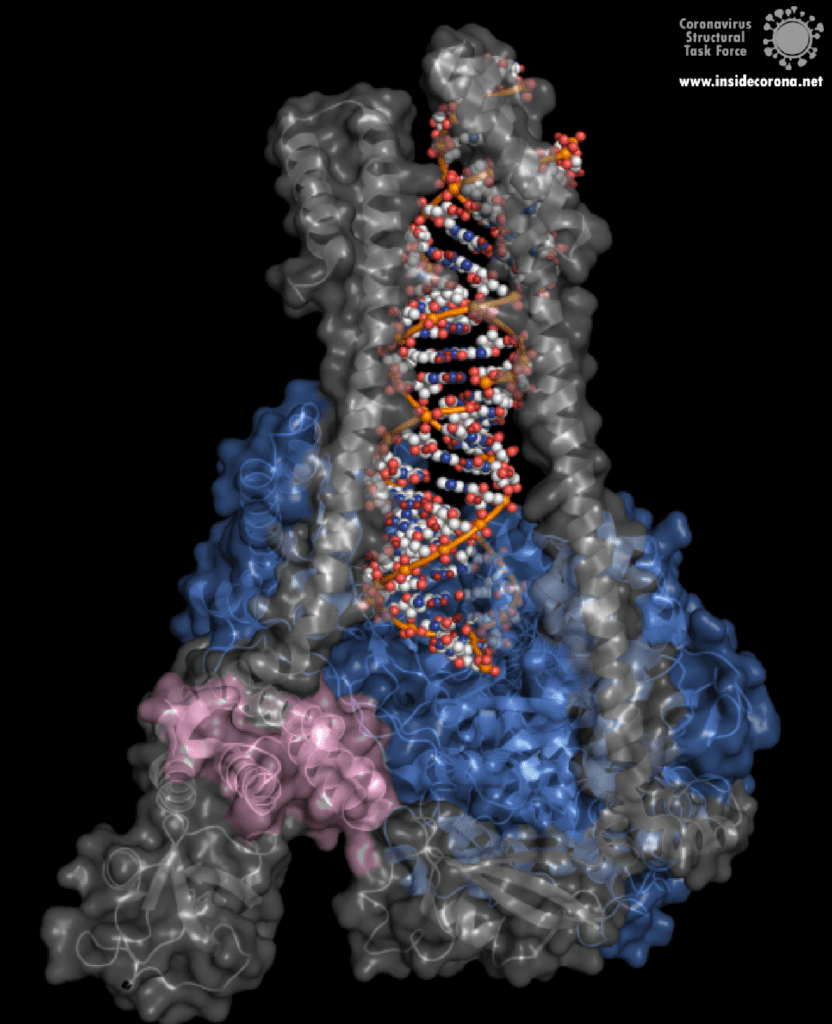
In der Mitte des Proteins befindet sich das „aktive Zentrum“, in dem der eigentliche Synthesevorgang stattfindet. Die Aminosäuren der Polymerase im aktiven Zentrum ermöglichen eine besonders hohe Polymerisationsrate. Die Polymerase kann bis zu 100 Nukleotide pro Sekunde aneinanderreihen [3]. RNA-Moleküle, die für die Produktion der RNA-Kette benötigt werden, gelangen durch ein Fenster in das aktive Zentrum. An dieser Stelle können nun antivirale Medikamente ansetzen:
Wie können antivirale Medikamente RNA-abhängige RNA-Polymerase hemmen?
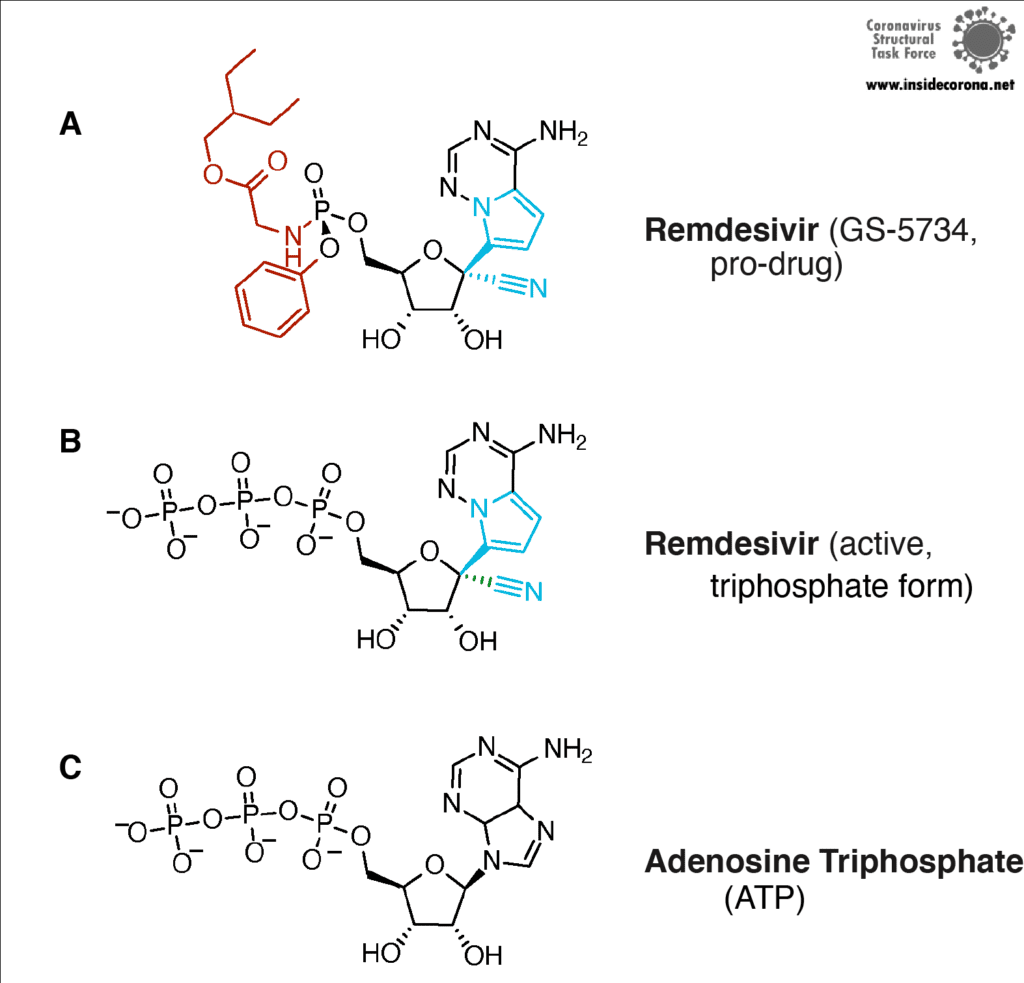
Remdesivir ist das von der FDA zugelassene Medikament des Herstellers Gilead, welches im Fokus der Suche nach einem Heilmittel gegen COVID-19 steht. Remdesivir (das mit dem Entwicklungscode GS-5734 unter dem Markennamen Veklury vertrieben wird) ist ein „Nukleotid-Analogon“, also eine synthetisch hergestellte Substanz, die in Form und Chemie den Bausteinen von RNA und DNA (Nukleotiden) ähnelt (siehe Abbildung 4).
Remdesivir wurde ursprünglich als generelles antivirales Medikamente entwickelt und zeigte in Labortests an Zellen und in klinischen Tests an Affen seine Wirksamkeit gegen das Ebolavirus [4]. Doch ist die Forschung dahingehend noch sehr jung und die Mühlen der Wissenschaft mahlen so langsam, dass bis zur COVID-19-Pandemie keine groß angelegten klinischen Studien mit Remdesivir durchgeführt wurden. Wissenschaftler und Ärzte wollten das Medikament schnell gegen COVID-19 einsetzen, um zu sehen, ob es auch hier half. Sowohl die USA als auch Japan erteilten dem Medikament bereits im Mai eine „Zulassung für die Anwendung in Notfallsituationen“ für Patienten mit schwerem COVID-19-Verlauf [5], [6].Woraufhin Remdesivir im Juli von der Europäischen Arzneimittelbehörde eine „bedingte Zulassung“ erhielt (welche für Medikamente vergeben wird, die eine medizinische Versorgungslücke schließen, aber über nicht genügend Daten für eine normale Zulassung verfügen). Damit kann Remdesivir bis zum nächsten Jahr bei Patienten mit schweren COVID-19-Verläufen eingesetzt werden [7].
Wie ist es denn aber möglich, dass ein Medikament gegen Ebola, Influenza oder eine andere Viruserkrankung auch bei COVID-19 hilft? Ich habe mir diese Frage immer und immer wieder gestellt, als die Studien über die Medikamentenwirksamkeit veröffentlicht wurden – und ich stand damit ganz sicher nicht alleine...
Die simple Antwort lautet: Alle diese Viren müssen ihr RNA-Genom vervielfältigen und verwenden hierzu das im Wesentlichen gleiche Werkzeug, nämlich eine RNA-abhängige RNA-Polymerase. Und alle Medikamente aus der Gruppe der Nukleotid-Analoga bemühen den gleichen Trick: sie geben sich als Ribonukleotide (also die eingangs beschriebenen „Perlen“) aus und gelangen so in das aktive Zentrum der RNA Polymerase. Im Inneren angekommen, docken sie dauerhaft am aktiven Zentrum an und bringen die Polymerase-Maschine zum Stillstand. Weil dieser Trick bei jeder viralen RNA-Polymerase funktionieren sollte, könnte man diese Wirkstoffe bei allen RNA-Viren als antivirale Medikamente einsetzen. In der Praxis sieht es natürlich etwas anders aus, weil zwischen den verschiedenen RNA-Polymerasen eben doch Unterschiede bestehen. Aber es ist ein guter Ausgangspunkt. Wenn wir über einsatzbereite allgemeine Virostatika gegen SARS-CoV-2 verfügen, sind wir vermutlich besser für einen künftigen Coronavirus-Ausbruch gerüstet!

Abbildung 3. Wahrscheinlich sehen wir alle nur, was wir sehen wollen.
Die Chemie von Remdesivir
In seiner Struktur ähnelt Remdesivir dem Nukleotid Adenosin, doch einige ausgeklügelte chemische Anhänge machen es zu einem besonders raffinierten Medikament (vielen Dank an die medizinische Chemie!). Wird Remdeivir injiziert, gelangt es in unsere Zellen, die es als Fremdkörper erkennen und zu verdauen versuchen. Dabei entfernen die Zellen allerdings nur die chemischen Anhänge. Was übrig bleibt, halten sie fälschlicherweise für ein normales Adenosin. In infizierten Zellen bindet nun die virale RNA-abhängige RNA-Polymerase dieses Moleküle und baut es anstelle von Adenosinmolekülen in den neu synthetisierten RNA-Strang ein. Remdesivir wird Teil der RNA, blockiert die Polymerase und verhindert, dass das Virus weitere Kopien seines Erbguts anfertigen kann. Dadurch kommt die Virusreplikation letztlich zu einem Stillstand und hilft dem Patienten, das Virus zu bekämpfen.
Ein anderes Medikament, das die RNA-Polymerase-Aktivität hemmt, ist Favipiravir, das unter den Markennamen Avigan, Abigan und FabiFlu vertrieben wird. Favipiravir wurde von Toyama Chemical Co. Ltd. in Japan entdeckt und wirkt ähnlich wie Remdesivir, allerdings imitiert es statt eines Adenosin-Nukleotids ein Guanosin- Nukleotid [8]. Dieses Medikament wurde bereits 2014 in Japan für den Einsatz bei resistenten Fällen von Influenza A und B zugelassen, wartet in den USA (erst in der klinischen Phase II und III) und in Großbritannien allerdings noch auf seine Freigabe [9]. Außerdem wird das Medikament in 43 Ländern für den Einsatz getestet. Die Zulassung von Favipiravir als COVID-19-Medikament erfolgte in einigen Ländern sehr rasch. So erteilte China am 15. März 2020 die Freigabe, Russland am 3. Juni 2020 und Indien am 20. Juni 2020 [10], [11]. Andere Länder, wie Japan, befinden sich noch in unterschiedlichen klinischen Teststufen und die Ergebnisse werden bis Ende Juli 2020 erwartet [10].
Heißt das, wir haben ein Heilmittel gegen SARS-CoV-2?
Leider noch nicht. Zwar hat Remdesivir die klinischen Studien mit beispielloser Geschwindigkeit durchlaufen, doch ist noch mehr Arbeit nötig, um sicher sein zu können, dass es unbedenklich und vorallem auch wirksam ist. Insgesamt wurden noch nicht besonders viele Menschen mit Remdesivir behandelt, so dass wir nicht wirklich sagen können, welche Nebenwirkungen es haben kann; zuletzt gab es Hinweise auf eine Schädigung von Leber und Niere [12, 13]. Die häufigsten Nebenwirkungen sind Übelkeit (10% bzw. 9% der Patienten), Verdauungsstörungen (7 %) und erhöhte Transaminasewerte (6 % bzw. 8 %). In einer Studie mussten 3,6 % der Patienten in einer 10-Tage-Studie die Therapie aus letzterem Grund abbrechen. Allerdings können auch schwere Virusinfektionen Leberschäden verursachen. Die Trennung der beiden Ursachen stellt eine große Herausforderung dar. Außerdem ist Remdesivir kein Allheilmittel. In einer Studie verkürzte sich unter Remdesivir die Genesungszeit von 15 auf 11 Tage; bei Patienten mit leichter bis mittelschwerer Erkrankung zeigte es jedoch keine Wirkung und bei Patienten, die bereits beatmet wurden, konnte kein Unterschied in der mittleren Genesungszeit festgestellt werden [14]. Da das Medikament über mehrere Tage als Infusion verabreicht werden muss, gibt es ein ziemlich kleines Zeitfenster, in dem Remdesivir tatsächlich helfen kann.
Wie auch Remdesivir hat Favipiravir seine eigenen Nebenwirkungen. Dazu zählen unter anderem Die Schädigung von Leber und Niere, erhöhte Harnsäurewerte, Hautallergien usw. [15]. Aus diesem Grund soll es bei Patienten mit schwerer Diabetes und schweren Herzerkrankungen nicht eingesetzt werden. Zudem ist es für schwangere Frauen nicht geeignet, da es Missbildungen oder ein Absterben des Fötus verursachen kann. Es hat sich gezeigt, dass Favipiravir nur im Anfangsstadium einer SARS-CoV-2-Infektion wirkt, wenn das körpereigene Immunsystem noch gut funktioniert. Bei schwer erkrankten Patienten kann es einen „Zytokinsturm“ auslösen (bei dem das Immunsystem lebensbedrohlich entgleist). Ein universelles Medikament gegen COVID-19 müsste aber für alle Menschen sicher sein.
Diese Medikamente sind jedoch besser als nichts. Und indem Wissenschaftler die beteiligten Mechanismen verstehen lernen, können sie vorhandene Medikamente zum Nutzen aller weiter verbessern. Während die meisten an der RNA-Polymerase ansetzenden „allgemeinen Virostatika“ bei SARS-CoV-2 versagt haben, war Remdesivir hingegen manchmal erfolgreich. Die Wissenschaft vermutet, dass seine begrenzte Wirksamkeit an einem SARS-CoV-2-eigenen Korrekturprotein namens Exonuklease liegt. Sobald die RNA-Polymerase neue RNA gebildet hat, prüft die Exonuklease diese auf Richtigkeit. Eine Studie hat gezeigt, dass ein anderer RNA-simulierender Arzneistoff namens Ribivarin unmittelbar nach der RNA-Synthetisierung erkannt und anschließend durch die Exonuklease wieder aus der RNA entfernt wird. Die Reparaturmechanismen scheinen für Remdesivir jedoch nicht gut zu funktionieren, was erklärt, warum es erfolgreicher ist als andere Medikamente [17], [18].
Wie nsp14 die Integrität und Virulenz von SARS-CoV-2 aufrechterhält, lesen Sie in einem zukünftigen Blog-Eintrag!

Abbildung 6. Haben wir das nicht alle schon erlebt?
Empfohlene Strukturen
Wer die Strukturen eingehender zu studieren möchte, findet diese in unserem GitHub-Repository, zusammen mit Informationen zur Validierung und, soweit vorhanden, zu verbesserten Strukturen. Für einen hochauflösenden Vergleich des aktiven Zentrums mit und ohne Remdesivir wurden 7BV2 bzw. 7BV1 zusammen bei 2,5 bzw. 2,8 Å Auflösung veröffentlicht. In der wachsenden Struktur des oben gezeigten Komplexes (6YYT) sind sowohl die Polymerase als auch die Kofaktoren und die RNA mit wenig „fehlender“ Dichte und einer Auflösung von 2,9 Å sehr gut aufgelöst. Sie ist wahrscheinlich 6M71 und 7BTF vorzuziehen, die mit einer ähnlichen Auflösung veröffentlicht wurden, wobei allerdings der Komplex weniger detailliert ist und keine RNA vorliegt. Für Interessierte: 7C2K und 7BZF (bei 2,93 Å und 3,26 Å) zeigen den an die RNA gebundenen Komplex vor und nach der Translokation.
Quellen
[1] J. S. Morse, T. Lalonde, S. Xu, and W. R. Liu, “Learning from the Past: Possible Urgent Prevention and Treatment Options for Severe Acute Respiratory Infections Caused by 2019-nCoV,” ChemBioChem, vol. 21, no. 5, pp. 730–738, Mar. 2020, doi: 10.1002/cbic.202000047.
[2] H. S. Hillen, G. Kokic, L. Farnung, C. Dienemann, D. Tegunov, and P. Cramer, “Structure of replicating SARS-CoV-2 polymerase,” Nature, May 2020, doi: 10.1038/s41586-020-2368-8.
[3] W. Yin et al., “Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir,” Science, p. eabc1560, May 2020, doi: 10.1126/science.abc1560.
[4] R. T. Eastman et al., “Remdesivir: A Review of Its Discovery and Development Leading to Emergency Use Authorization for Treatment of COVID-19,” ACS Cent. Sci., May 2020, doi: 10.1021/acscentsci.0c00489.
[5] O. of the Commissioner, “Coronavirus (COVID-19) Update: FDA Issues Emergency Use Authorization for Potential COVID-19 Treatment,” FDA, May 04, 2020. https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-issues-emergency-use-authorization-potential-covid-19-treatment (accessed Jul. 08, 2020).
[6] A. Sternlicht, “Japan Approves Remdesivir For Use On Severe COVID-19 Patients,” Forbes. https://www.forbes.com/sites/alexandrasternlicht/2020/05/07/japan-approves-remdesivir-for-use-on-severe-covid-19-patients/ (accessed Jul. 08, 2020).
[7] D. CZARSKA-THORLEY, “First COVID-19 treatment recommended for EU authorisation,” European Medicines Agency, Jun. 25, 2020. https://www.ema.europa.eu/en/news/first-covid-19-treatment-recommended-eu-authorisation (accessed Jul. 10, 2020).
[8] E. De Clercq, “New Nucleoside Analogues for the Treatment of Hemorrhagic Fever Virus Infections,” Chem. Asian J., vol. 14, no. 22, pp. 3962–3968, Nov. 2019, doi: 10.1002/asia.201900841.
[9] K. Shiraki and T. Daikoku, “Favipiravir, an anti-influenza drug against life-threatening RNA virus infections,” Pharmacol. Ther., vol. 209, p. 107512, May 2020, doi: 10.1016/j.pharmthera.2020.107512.
[10] T. Hornyak, “Japan sending Fujifilm’s flu drug favipiravir to over 40 countries for Covid-19 trials,” CNBC, May 04, 2020. https://www.cnbc.com/2020/05/04/fujifilms-flu-drug-favipiravir-sent-to-43-nations-for-covid-19-trials.html (accessed Jul. 14, 2020).
[11] G. P. Ltd, “Glenmark Becomes the First Pharmaceutical Company in India to Receive Regulatory Approval for Oral Antiviral Favipiravir, for the Treatment of Mild to Moderate COVID-19.” https://www.prnewswire.com/in/news-releases/glenmark-becomes-the-first-pharmaceutical-company-in-india-to-receive-regulatory-approval-for-oral-antiviral-favipiravir-for-the-treatment-of-mild-to-moderate-covid-19-855346546.html (accessed Jul. 14, 2020).
[12] Goldman, J. D. et al. Remdesivir for 5 or 10 Days in Patients with Severe Covid-19. N. Engl. J. Med. (2020) doi:10.1056/NEJMoa2015301
[13] Remdesivir Safety Forecast: Watch the Liver, Kidneys | MedPage Today. https://www.medpagetoday.com/infectiousdisease/covid19/86582
[14] J. H. Beigel et al., “Remdesivir for the Treatment of Covid-19 — Preliminary Report,” N. Engl. J. Med., vol. 0, no. 0, p. null, May 2020, doi: 10.1056/NEJMoa2007764.
[15] Sandhya Ramesh, “Favipiravir, Japanese drug that’s the new Covid treatment hope your chemist will soon stock,” ThePrint, Jun. 25, 2020. https://theprint.in/health/favipiravir-japanese-drug-thats-the-new-covid-treatment-hope-your-chemist-will-soon-stock/447987/ (accessed Jul. 14, 2020).
[16] F. Ferron et al., “Structural and molecular basis of mismatch correction and ribavirin excision from coronavirus RNA,” Proc. Natl. Acad. Sci., vol. 115, no. 2, pp. E162–E171, Jan. 2018, doi: 10.1073/pnas.1718806115.
[17] C. J. Gordon, E. P. Tchesnokov, J. Y. Feng, D. P. Porter, and M. Gotte, “The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome coronavirus,” J. Biol. Chem., Feb. 2020, doi: 10.1074/jbc.AC120.013056.
[18] L. Zhang et al., “Role of 1’-Ribose Cyano Substitution for Remdesivir to Effectively Inhibit both Nucleotide Addition and Proofreading in SARS-CoV-2 Viral RNA Replication,” bioRxiv, p. 2020.04.27.063859, Apr. 2020, doi: 10.1101/2020.04.27.063859.
