Warum werden Impfstoffe so schnell und Medikamente so langsam entwickelt?
Im März 2020 erklärte die WHO die Krankheit COVID-19, ausgelöst durch das neuartige Coronavirus SARS-CoV-2, zur Pandemie. Seitdem haben es 14 Impfstoffe auf den Weltmarkt geschafft [1] und die Zahl der geimpften Menschen wächst jeden Tag. Noch nie war die Entwicklung eines Impfstoffes so schnell. Und obwohl viele Leben dadurch gerettet werden, gibt es immer noch viele Infizierte. Um Patienten mit schwerem COVID-19 zu helfen und die Gesundheitssysteme vor dem Kollaps zu bewahren, sind wirksame Medikamtente der nächste Schritt. Aber sollte es nicht bereits welche geben?
Was ist der Unterschied zwischen Impfstoffen und Medikamenten?
Während Impfstoffe nicht-infizierte Menschen vor einer möglichen Infektion schützen, helfen Medikamente erkrankten Menschen. Sie lindern die Symptome und verkürzen die Zeit bis zur Genesung. Um eine Pandemie nachhaltig zu bekämpfen, sind Impfstoffe unerlässlich. Der Erreger hat bei genug geimpften Menschen keine Chance mehr, jemanden zu infizieren. Die Herdenimmunität schützt außerdem diejenigen, die beispielsweise wegen eines angeschlagenen Immunsystems nicht geimpft werden können. Risikogruppen, die eine Infektion eventuell nicht überleben würden, werden besser vor einer Infektion geschützt. Medikamente sind jedoch ebenso wichtig für akute Infektionen, deren Verlauf man nicht immer vorhersagen kann.
Wie funktioniert die Entwicklung eines Impfstoffs?
Am Anfang erforschen Wissenschaftler den Virus und die Art, wie er eine Krankheit auslöst. Hierbei ist es wichtig, die Wirkung der Virusbestanteile im Detail zu verstehen. Auf dieser Basis schlagen die Forscher dann einen Teil des Virus vor, gegen den sich ein Impfstoff richten kann. Diese erste Laborphase wird als Research & Discovery-Phase bezeichnet. Was folgt, sind präklinische Versuche, die an Zellen oder Tieren durchgeführt werden. Hier prüfen die Wissenschaftler, ob ihr Impfstoffkandidat eine Immunantwort hervorrufen kann und ungiftig ist. Wenn alle bis zu diesem Zeitpunkt gesammelten Daten vielversprechend aussehen, folgt eine klinische Studie, in deren Verlauf der Impfstoff am Menschen getestet wird.
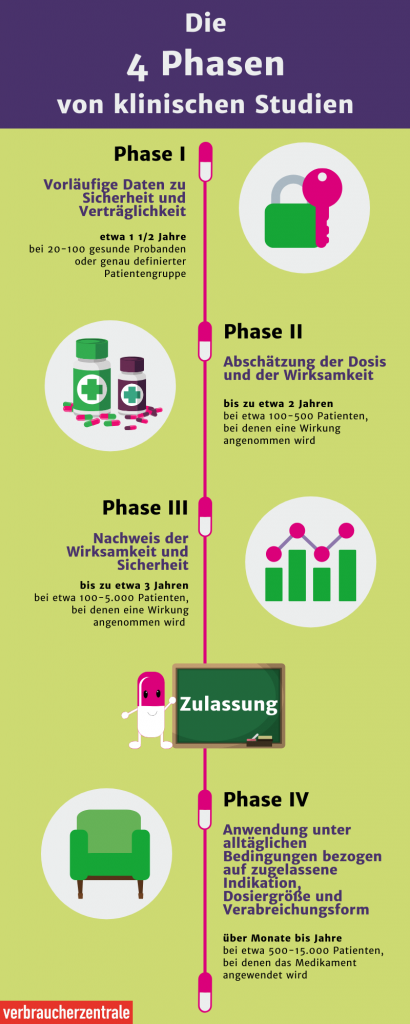
- In Phase I werden die Sicherheit und die korrekte Dosierung für den Impfstoff sowie die Immunreaktion untersucht.
- Während Phase II werden Sicherheit, Wirksamkeit, Dosierung und Immunreaktion an einer größeren und vielfältigeren Gruppe von Menschen getestet.
- In Phase III wird der Impfstoff an Tausenden von Probanden getestet, um Wirksamkeit und Nebenwirkungen zu bestimmen.
- Nur wenn der Impfstoff alle Phasen erfolgreich besteht, wird er von der FDA in den USA oder der EMA in der EU zugelassen. Nach der Zulassung wird der Impfstoff in der realen Welt überwacht und weitere Daten werden gesammelt.
Warum ging die Entwicklung so schnell? Wurde die Zulassung übereilt?
Am 10. Januar 2020 wurde das Genom von SARS-CoV-2 von chinesischen und australischen Wissenschaftlern veröffentlicht[2]. Sofort begann die weltweite Entwicklung von Impfstoffen. Zum ersten Mal arbeiteten Unternehmen, Regierungen und Wissenschaftler aus dem akademischen Bereich in diesem Umfang zusammen, um die Pandemie zu beenden. In den USA und in der EU wurde im Dezember 2020 als erster Impfstoff Comirnaty von Pfizer/BioNTech zugelassen. Seine Entwicklung dauerte nur elf Monate – eine Rekordzeit, die vorher für keinen anderen Impfstoff erreicht wurde.
Der am schnellsten entwickelte Impfstoff vor Corona war jener gegen Mumps in den 1960er Jahren[3]. Seine Entwicklung dauerte nur vier Jahre, was im Vergleich zu den durchschnittlich 10 Jahren, die ein Impfstoff von der Grundlagenforschung bis zur Zulassung braucht[4], erstaunlich schnell ist. Wie ist es also möglich, dass die Corona-Impfstoffe in unter einem Jahr auf den Markt kamen?
SARS-CoV-2 kam für die Virusforschung nicht aus dem Nichts. Seit Jahren studieren Wissenschaftler seine Verwandten SARS und MERS ‒ ihre Art, Zellen zu infizieren, ihre Proteine und ihre Genetik[5]. Aus diesem Grund mussten die Wissenschaftler bei der Erforschung des neuen Coronavirus nicht bei Null anfangen. Natürlich gibt es Unterschiede, aber das Grundgerüst der Viren weist viele Ähnlichkeiten auf.
Die Kosten für die Entwicklung eines Impfstoffs übersteigen im Durchschnitt die 1-Milliarden-Dollar-Marke[6]. Ein Großteil dieses Geldes wird für Kandidaten ausgegeben, die sich später als Fehlschläge erweisen. Bei vielen Impfstoffen kann die Finanzierung nicht während der gesamten Entwicklung aufrechterhalten werden, vor allem wenn Infektionen selten sind oder nur lokal auftreten. Bei der Entwicklung von SARS-CoV-2-Impfstoffen war Geld kein Problem. Dank der massiven Finanzierung durch Regierungen und Unternehmen hatten die Wissenschaftler ausreichend Ressourcen, um ihre Impfstoffkandidaten zu testen. Außerdem konnten die Entwickler so mehrere Testphasen parallel laufen lassen[7].
Der wahrscheinlich interessanteste Grund für die schnelle Impfstoffentwicklung sind die neuen Impfstofftechnologien, deren Entwicklung seit der Jahrtausendwende vorangetrieben wird: mRNA- und Vektorimpfstoffe. Wissenschaftler bezeichnen sie oft als Impfstoffplattformen, weil es sich um Technologien handelt, in die man nur den Teil einfügen muss, der spezifisch für ein Virus ist. Dazu braucht man die genetische Information des Virus, die schon früh in dieser Pandemie veröffentlicht wurde. Die Impfstoffentwickler passten also ihre Systeme an SARS-CoV-2 an und konnten so schnellstmöglich mit den präklinischen und klinischen Versuchen starten.
In der Vergangenheit wurden inaktivierte Viren oder isolierte virale Proteine in Impfstoffen verwendet. Diese sind aber sehr spezifisch für das Virus, das man bekämpfen will. Das bedeutet, dass man jedes Mal, wenn ein neuer Impfstoff entwickelt wurde, wieder bei den Grundlagen anfangen musste. Für die Zukunft hoffen Forscher, dass durch die neuen Impfstoffplattformen die Zeit für die Impfstoffentwicklung viel kürzer sein wird.
Wo liegt der Unterschied zur Medikamenten-Entwicklung? Und warum dauert sie so lang?
Auch die Entwicklung eines neuen Medikaments dauert Jahre. Generell zeigen die Zeitleisten für die Entwicklung von Medikamenten und Impfstoffen ähnliche Schritte: Research & Discovery, präklinische und klinische Studien, Zulassung und Überwachung gelten auch für die Medikamentenentwicklung.
Bis zur Zulassung kostet die Entwicklung eines neuen Medikamentes ca. 1,3 Milliarden US-Dollar[8], und Misserfolge sind auf jeder Stufe des Weges möglich – wie z. B. vielversprechende Kandidaten aus der Präklinik, die am Menschen keine Wirkung zeigen, etc.
Wenn man die moderne Medikamentenentwicklung mit den neuen Impfstoffplattformen vergleicht, wird klar, wie viel komplizierter erstere ist. Antivirale Medikamente sind Moleküle, die mit Teilen des Virus interagieren und es daran hindern, in eine Zelle einzudringen oder sich zu vermehren. Es gibt auch Medikamente, die mit Teilen unseres eigenen Immunsystems interagieren, um eine Eskalation der Krankheit zu verhindern.
Strukturell muss ein Wirkstoff genau zu seinem Angriffspunkt passen, der oft ein Virusprotein ist. Daraus ergeben sich zwei Probleme: Welches Protein soll gewählt werden und wie muss der Wirkstoff auf molekularer Ebene aussehen.
Heutzutage werden Millionen von Molekülen auf ihre Interaktion mit viralen Zielproteinen untersucht. Dies geschieht zwar durch computergestützte Modelle, nimmt aber dennoch viel Zeit in Anspruch. Sobald eine Leitstruktur – ein potenziell wirksames Molekül – gefunden ist, wird es in präklinischen Studien getestet und strukturell optimiert. Während der Optimierung werden Hunderte von ähnlichen Molekülen verglichen, um zu sehen, ob sich ihre Eigenschaften verbessern.
Verschiedene Ansätze zur Entwicklung eines Medikaments nehmen unterschiedlich viel Zeit in Anspruch. Eine Abkürzung zur Entwicklung einer wirksamen Behandlung ist das Repurposing, also Umfunktionieren, eines bereits zugelassenen Medikaments oder eines auf Eis gelegten Kandidaten. Der zweitschnellste Weg ist die Entwicklung eines therapeutischen Antikörpers, gefolgt von einem klassischen Screening nach einem neuen Wirkstoff.
Umfunktionieren von Medikamenten für neue Krankheiten
Die Wiederverwendung von Medikamenten oder Medikamentenkandidaten, die bereits auf ihre Sicherheit geprüft wurden, verkürzt die Entwicklungszeit erheblich. Noch besser ist es, wenn ein bereits zugelassenes Medikament oder ein Medikament, das bereits durch viele Daten aus Humanstudien gestützt wird, eine Wirkung auf die neue Krankheit zeigt.
Ein Beispiel dafür ist das erste HIV-Medikament AZT. Es wurde 1964 als Krebsmedikament entwickelt, erwies sich aber später als unwirksam. In den 1980er Jahren wurde es in ein Screening zur AIDS-Behandlung aufgenommen und konnte die Replikation von HIV stören. Später wurde gezeigt, dass es die Sterberate bei Menschen mit AIDS senkt, und es konnte zur Behandlung zugelassen werden[9].
Remdesivir – eine Sackgasse?
Remdesivir ist ein antivirales Medikament, das entwickelt wurde, um die Replikation von RNA-Viren zu stoppen. Zunächst entwickelte man es für die Behandlung von Hepatitis C und das HRS-Virus, es wurde später aber auch gegen Ebola[10] getestet, was aber keine überzeugenden Ergebnisse lieferte[11].
Doch was sagen COVID-19-Studien mit Remdesivir?
Die EU und die USA haben dieses Medikament im Jahr 2020 zugelassen, basierend auf Studien mit Patienten, die mittelschwere oder schwere Verläufe der Erkrankung hatten. Eine Studie ergab, dass Krankenhauspatienten mit moderatem COVID-19 von einer 5-tägigen Behandlung mit Remdesivir profitierten[12]. Für schwere Fälle gibt es Hinweise, dass Remdesivir die Zeit bis zur Genesung besser verkürzen konnte als ein Placebo[13].
Doch die WHO rät inzwischen vom Einsatz des Medikaments ab, da sie in einer eigenen Meta-Analyse keinen positiven Effekt belegen konnten. Dies hat die EMA dazu bewogen, Remdesivir neu zu bewerten und möglicherweise sogar die Zulassung in der EU zurückzunehmen[14]. In der WHO-Studie wurde die Wirkung von vier umfunktionierten COVID-19-Behandlungen – darunter Remdesivir – an 11.330 Erwachsenen untersucht[15]. In dieser Analyse zeigte Remdesivir wenig oder keinen Effekt auf Patienten mit COVID-19, gemessen an der Gesamtsterblichkeit, der Notwendigkeit der Beatmung und der Dauer des Krankenhausaufenthalts.
Die anderen geprüften Medikamente aus der WHO-Analyse waren Hydroxychloroquin (ein Mittel gegen Malaria), Lopinavir (ein Proteaseinhibitor, der gegen HIV eingesetzt wird) und Interferon beta-1a (ein immunmodulierendes Medikament zur Behandlung von MS). Keines davon zeigte eine ausreichende Wirkung gegen akutes COVID-19.
Dexamethason ‒ eine vielversprechende Behandlung
Der gefährlichste Aspekt einer COVID-19-Infektion ist, dass das Immunsystem überreagiert und den Körper zusätzlich zum Virus angreift. Steroide werden oft eingesetzt, um eine Reaktion des Immunsystems zu dämpfen, daher wurde das allgemein verfügbare Medikament Dexamethason als Behandlung ausprobiert. Dieses hat sich bisher als wirksam erwiesen und gehört mittlerweile zur Standardbehandlung von COVID-19-Patienten in den USA[16].
Andere Medikamente, die gerade untersucht werden
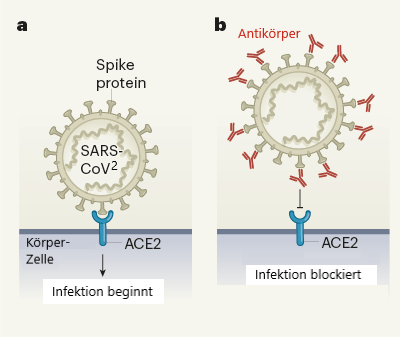
Die Behandlung mit monoklonalen Antikörpern wird derzeit in der EU und den USA geprüft[17]. Ihre Wirkung: Wenn sich der Antikörper an das Spike-Protein anlagert, kann das Virus nicht in die Körperzellen eindringen. Einige dieser Behandlungen sind Kombinationen aus zwei verschiedenen Antikörpern, die sich an unterschiedliche Teile des Spike-Proteins anlagern können und es so theoretisch besser binden.
Die drei Behandlungen, die sich derzeit in der EMA-Prüfungspipeline befinden, sind: Bamlanivimab und Etesevimab, REGN-COV2[18], und Regdanvimab[19]. Die FDA[20] hat mehrere monoklonale Antikörper für den Notfalleinsatz zugelassen und es hat sich gezeigt, dass sie die Symptome von COVID-19 wirksam reduzieren, wenn sie früh im Krankheitsverlauf gegeben werden[21].
Laufende Forschung
Da es immer mehr Strukturdaten über die Proteine von SARS-CoV-2 gibt, gibt es auch immer mehr Interaktionsstudien mit potenziellen Wirkstoffen und -kombinationen.
Doch die Medikamentenentwicklung braucht Zeit. Im Vergleich zu Impfstoffen, die gerade eine technologische Revolution erlebt haben, brauchen Medikamente länger von der Grundlagenforschung bis zum Einsatz. Aber es sind bereits viele verschiedene Medikamente in der Entwicklung, da die Finanzierung für COVID-19-Behandlungen kein Problem darstellt und auch die internationale Zusammenarbeit den Prozess beschleunigt.
Ob einer der aktuellen Kandidaten bei der Behandlung von COVID-19 wirksam sein wird, muss sich erst noch zeigen. Vielleicht könnte sogar eine Kombinationstherapie mit mehreren Medikamenten die gewünschte Wirkung erzielen.
[1] https://www.unicef.org/supply/covid-19-vaccine-market-dashboard
[2] https://virological.org/t/novel-2019-coronavirus-genome/319
[3] Tulchinsky, Theodore H.. “Maurice Hilleman: Creator of Vaccines That Changed the World.” Case Studies in Public Health (2018): 443–470. doi:10.1016/B978-0-12-804571-8.00003-2
[4] COVID-19 vaccine development pipeline gears up. Mullard, Asher. The Lancet, Volume 395, Issue 10239, 1751 - 1752
[5] Abdelrahman Zeinab, Li Mengyuan, Wang Xiaosheng. Comparative Review of SARS-CoV-2, SARS-CoV, MERS-CoV, and Influenza A Respiratory Viruses. Frontiers in Immunology 11 (2020). doi:10.3389/fimmu.2020.552909
[6] Estimating the cost of vaccine development against epidemic infectious diseases: a cost minimisation study, Gouglas, Dimitrios et al. The Lancet Global Health, Volume 6, Issue 12, e1386 - e1396
[7] https://www.nature.com/articles/d41586-020-03626-1
[8] Wouters OJ, McKee M, Luyten J. Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009-2018. JAMA. 2020;323(9):844–853. doi:10.1001/jama.2020.1166
[9] https://www.niaid.nih.gov/diseases-conditions/antiretroviral-drug-development
[10] https://www.gilead.com/-/media/gilead-corporate/files/pdfs/covid-19/gilead_rdv-development-fact-sheet-2020.pdf
[11] Pardo, Joe et al. “The journey of remdesivir: from Ebola to COVID-19.” Drugs in context vol. 9 2020-4-14. 22 May. 2020, doi:10.7573/dic.2020-4-14
[12] https://jamanetwork.com/journals/jama/fullarticle/2769871
[13] https://www.nejm.org/doi/10.1056/NEJMoa2007764
[14] https://www.ema.europa.eu/en/news/update-remdesivir-ema-will-evaluate-new-data-solidarity-trial
[15] Repurposed Antiviral Drugs for Covid-19 — Interim WHO Solidarity Trial Results. 384, 497-511 (2020).
[16] https://www.covid19treatmentguidelines.nih.gov/immunomodulators/corticosteroids/
[17] https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/treatments-covid-19/covid-19-treatments-under-evaluation
[18] https://www.ema.europa.eu/en/news/ema-starts-rolling-review-regn-cov2-antibody-combination-casirivimab-imdevimab
[19] https://www.ema.europa.eu/en/news/ema-starts-rolling-review-celltrion-antibody-regdanvimab-covid-19
[20] https://www.fda.gov/consumers/consumer-updates/know-your-treatment-options-covid-19
[21] https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-monoclonal-antibodies-treatment-covid-19-0
